近日,南开大学生命科学学院、药物化学生物学全国重点实验室郭宇教授、饶子和院士、中国人民解放军总医院赵磊教授联合广州国家实验室、山西大学、北华大学、河北大学等多家单位在国际知名学术期刊《自然-通讯》上在线发表了题为“Self-assembling nanoparticle engineered from the ferritinophagy complex as a rabies virus vaccine candidate”的研究论文。研究团队基于铁蛋白与其天然受体结构复合物的高分辨率冷冻电镜结构,借助人工智能技术对天然受体的结合区进行了工程化改造,开发了一套新型通用疫苗递呈平台。进而,研究团队应用该平台开发了一种具有完全自主知识产权的新型狂犬候选疫苗,在动物水平展现出极佳的预防效果,充分验证了该平台的通用性和有效性。

自组装纳米颗粒疫苗载体能够模拟病毒表面抗原重复阵列的展示模式,具有安全性高、生物兼容性好、免疫原性强等多种优势。其中,铁蛋白因其出色的抗原呈递能力已经成为一种颇具前途的纳米递送平台,广泛应用于多种疾病疫苗的研发。但是,目前主流的铁蛋白抗原递呈方式也存在一些不足之处,如化学偶联导致的抗原异质性、融合蛋白表达有时无法正确折叠、大型标签偶联引入非必需免疫原性蛋白等诸多问题,亟需开发更加便捷高效的通用型铁蛋白纳米颗粒疫苗递呈系统。
为了克服上述难题,研究团队从天然进化的复合物作用模式中寻找灵感,选取人类铁蛋白重链(FTH1)与其天然受体NCOA4复合物为研究对象,解析了NCOA4碳末端结构域与FTH1复合物的高清冷冻电镜三维结构,进而采用生物信息学以及人工智能辅助工具,基于复合物的作用模式重新生成获得一个序列显著缩短(从40余个氨基酸残基优化至16个氨基酸残基)、结合亲和力显著提高(与铁蛋白之间亲和力提高了近一个数量级),且高度稳定的适配标签Fagy-tag。基于这一适配标签与铁蛋白载体构建的通用型纳米递呈平台不仅有效降低了接头蛋白本身的免疫原性,更展现出良好的兼容性,Fagy-tag两端可同时融合两种不同的抗原蛋白,以实现两种甚至多种不同抗原的等价精准递呈,大大拓展了铁蛋白自组装载体的广谱性,为研发多价疫苗提供了新的探索途径。
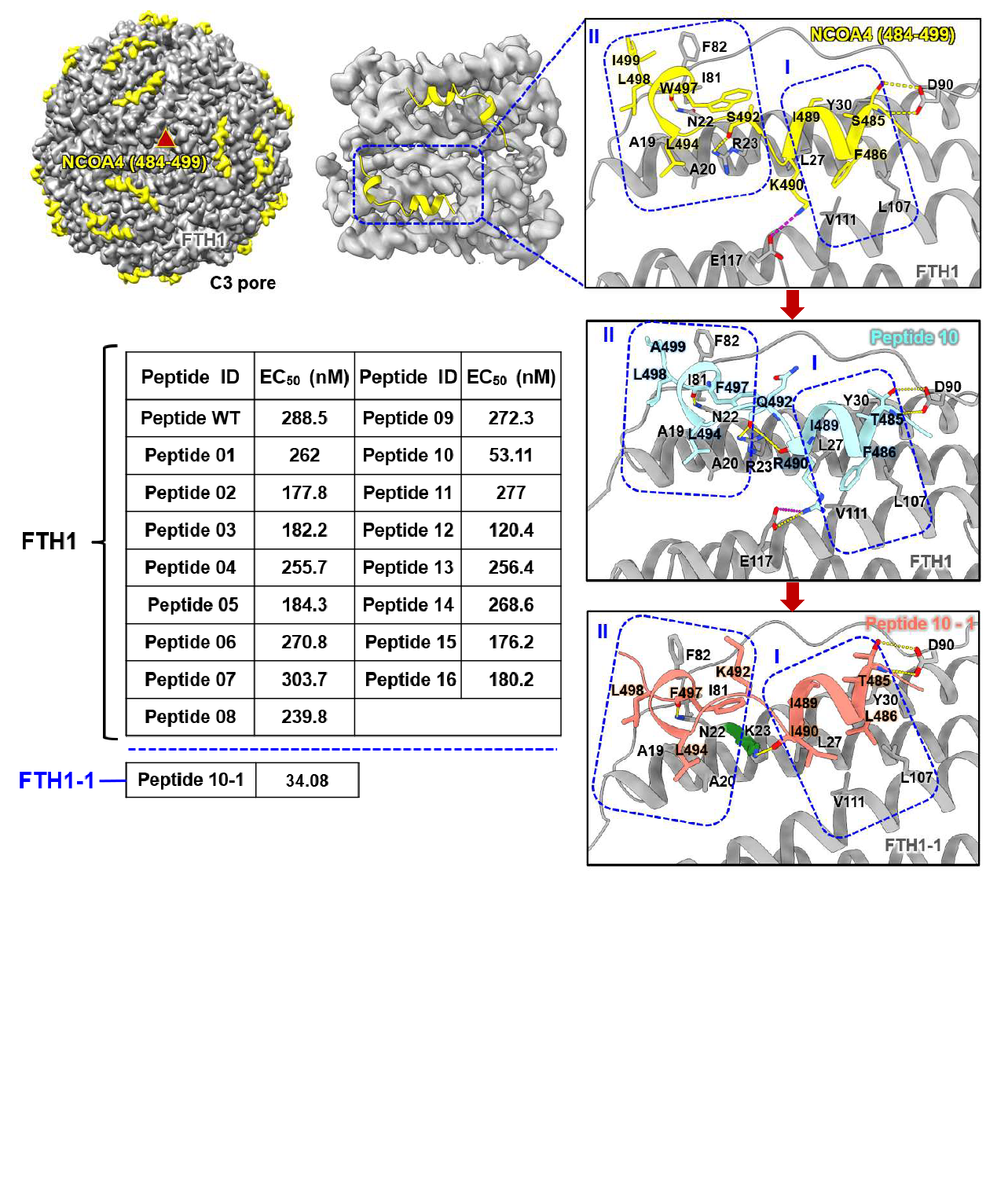
图1. 高亲和力短肽AI辅助设计及结构验证
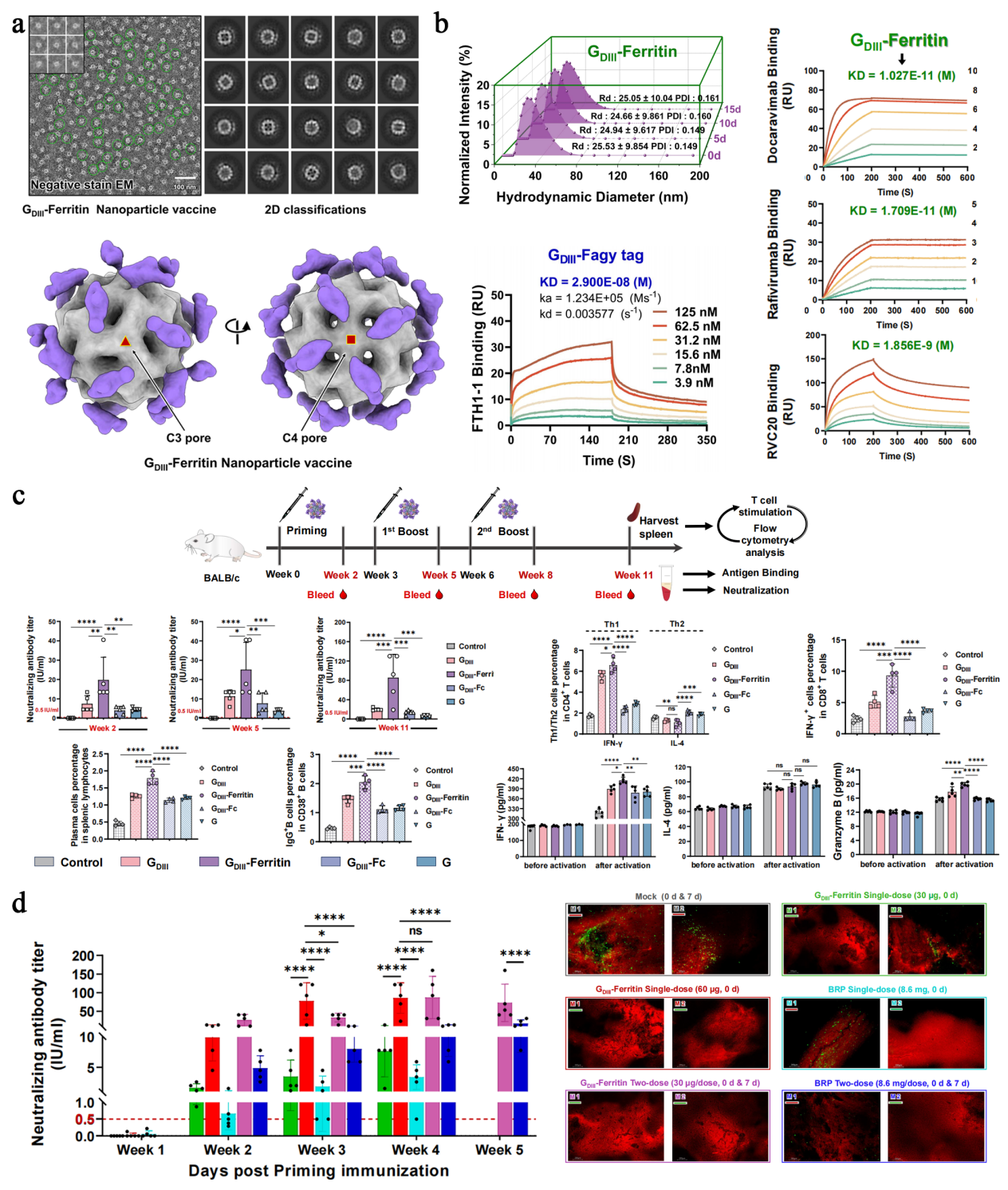
鉴于现有狂犬灭活疫苗在免疫应答水平、持续时间及经济性方面难以满足狂犬病全球清除行动的需求,研究团队选择狂犬病毒作为验证该平台的首个实例,将Fagy-tag标记的狂犬病毒(RABV)表面糖蛋白结构域III(GDIII)与FTH1-1共孵育,实现了GDIII在铁蛋白表面的高效展示,成功制备了一种基于新型自组装系统的狂犬病毒候选纳米颗粒疫苗。该疫苗具有制备方便、成本低廉,性质稳定的优点,并能耐受多变的运输存储条件及机械应力损伤,低剂量免疫接种便能够在受试小鼠体内诱导广泛、持久的体液免疫应答,以及强烈的CD4+ Th1偏向性细胞免疫应答和细胞毒性CD8+ T淋巴细胞免疫应答;相较于市售狂犬灭活疫苗大剂量多剂次(3-5剂次)繁琐复杂的免疫接种流程,GDIII-Ferritin纳米颗粒疫苗低剂量(60μg)、单剂次免疫即可对狂犬病毒脑内攻毒感染的小鼠产生完全的保护效果,具有显著的免疫优势和应用价值。该研究不仅对了解铁蛋白自噬铁稳态调节机制提供了准确的结构信息,更拓展了铁蛋白纳米颗粒疫苗的应用场景,为狂犬病防治提供了颇具前景的创新策略。
图2. 新型狂犬疫苗结构、性质表征及免疫学评价
南开大学药学院博士生付丹,山西大学分子科学研究所王文明副教授,北华大学公共卫生学院张岩教授为论文的共同第一作者;南开大学生命科学学院、药物化学生物学全国重点实验室郭宇教授、饶子和院士,中国人民解放军总医院赵磊教授为论文的共同通讯作者。该研究工作得到了国家重点研发计划、国家自然科学基金、河北省协同创新中心等经费支持,适配标签Fagy-tag及该新型狂犬疫苗已申请专利保护。