近日,南开大学药物化学生物学全国重点实验室和生命科学学院齐迹、孔德领等在血栓类疾病可视化协同治疗领域取得的最新研究成果以“Near-infrared-II photoacoustic imaging and photo-triggered synergistic treatment of thrombosis via fibrin-specific homopolymer nanoparticles”为题发表在国际著名期刊Nature Communications上。该团队设计开发了一种具有血栓高效靶向能力的新型有机分子探针,实现了活体层面长波长近红外二区光声成像可视化和热涌动与一氧化氮协同治疗血栓。

血管内闭塞性血栓的形成是许多危及生命的心血管疾病的罪魁祸首,这些疾病也是全球高发病率和致死的最主要原因。然而,传统的血栓检测方法存在一系列问题,例如信号弱、空间分辨率低以及检测耗时等,严重限制了其在实际诊断中的应用。光声成像具有较高的空间分辨率和较深的穿透深度,特别是近红外二区(NIR-II, 1000-1700 nm)波段有望获得更低的组织背景干扰,更高的组织穿透和信噪比。另一方面,临床使用的溶栓药物通常面临治疗效果不佳和安全风险大等问题,非药物溶栓作为一种新的策略开始受到关注,但是如何实现高效而且彻底的血栓治疗以及治疗过程的高分辨率可视化追踪仍然面临挑战。
传统给电子和吸电子单元交替排列的半导体聚合物由于较强的分子间静电相互作用严重限制了分子运动,而分子运动在提高光热转化和光声信号方面起着重要作用。该项工作设计并合成了一种新型的由一种单元组成的半导体均聚物,其分子间的排斥作用有利于促进分子运动,从而推动高效的光热转化。该聚合物与热响应的一氧化氮前体分子进行共组装并在表面修饰纤维蛋白靶向多肽制备具有血栓高度靶向性的纳米材料体系。通过体外和活体动物的对比实验研究,发现长波长NIR-II光声成像在血栓诊断方面具有独特的优势,能够有效提高组织穿透深度和空间分辨率,避免背景噪音的干扰,实现出色的成像诊断效果,并且能够对血栓的治疗过程进行高分辨率可视化。基于时空可控的光照热效应导致的热涌动和一氧化氮释放,二者协同用于血栓治疗。这种策略几乎可以完全溶解血栓,并防治复发,其治疗效果远优于临床使用的尿激酶等药物,在动物颈动脉和下肢动脉血栓等模型上均取得了非常显著的治疗效果。
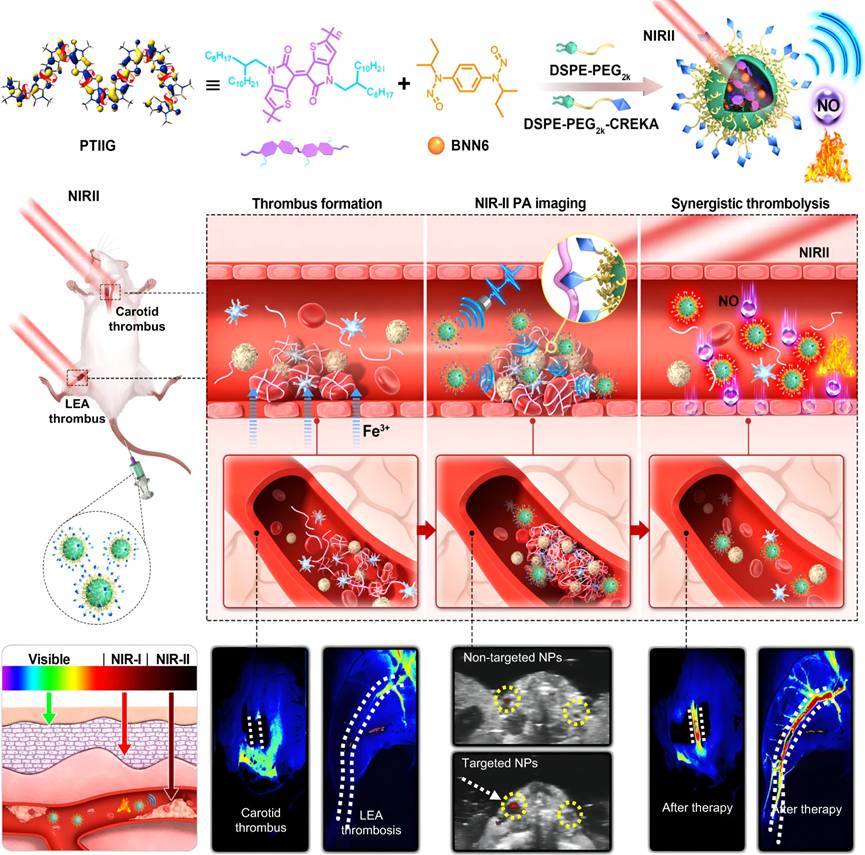
图:新型有机纳米探针用于长波长NIR-II光声成像和光触发协同血栓治疗的示意图和诊疗过程高分辨率可视化结果
该项研究报道了基于长波长NIR-II光声成像可视化诊疗的有机纳米体系不仅具有优异的光吸收能力,明亮的光声信号,强的组织穿透力和优异的血栓靶向性等特点,能够以超高的信噪比,选择性地点亮血栓部位,而且还整合这种精确的血栓检测能力和卓越的抗血栓活性于一体,首次实现了活体上对血栓的长波长NIR-II光声成像诊断及血栓协同治疗过程可视化,血栓局部的热涌动效应和按需释放一氧化氮的结合不仅可以有效溶解血栓,还可以促进纳米粒子渗透到血栓中,从而提高抗血栓效果。同时,这种无创的近红外光可控的溶栓体系还具有很好的生物相容性和较低的出血副作用风险,有望为血栓的诊断和治疗提供新的策略。
南开大学为该项工作的第一完成单位及通讯单位,生命科学学院2021级硕士研究生宋健文为该论文的第一作者,药物化学生物学全国重点实验室和生命科学学院齐迹、孔德领教授和中国医学科学院/北京协和医学院生物医学工程研究所李稳研究员为该论文的共同通讯作者。该工作得到了国家自然科学基金创新群体项目和海外高层次人才引进项目等的资助。
文章链接:https://www.nature.com/articles/s41467-023-42691-8
