近年在哺乳动物中开发的单倍体干细胞系,因其单基因组和自我更新等特色,在多种生物学现象的关键功能基因筛查研究中彰显巨大优势。南开大学药物化学生物学全国重点实验室帅领研究员已在单倍体干细胞与遗传学筛选领域深耕十余年,先后研发了小鼠、大鼠、猴子和人类四个物种的包括单倍体胚胎干细胞、单倍体神经干细胞和单倍体滋养层干细胞等多种类型的谱系特异单倍体干细胞系,并在毒性药物靶点、分化和去分化进程中关键调控基因等方面,全方位全覆盖的揭示未知功能基因。
近日,帅领课题组对内细胞团和滋养层谱系相互转变的机制又获得新发现,即对备选基因中突变频次最高的Dyrk1a进行敲除,可促使胚胎干细胞(ESCs)将分化潜能从多能性升级到全能性的状态,进而获得了分化到滋养层谱系的潜能。
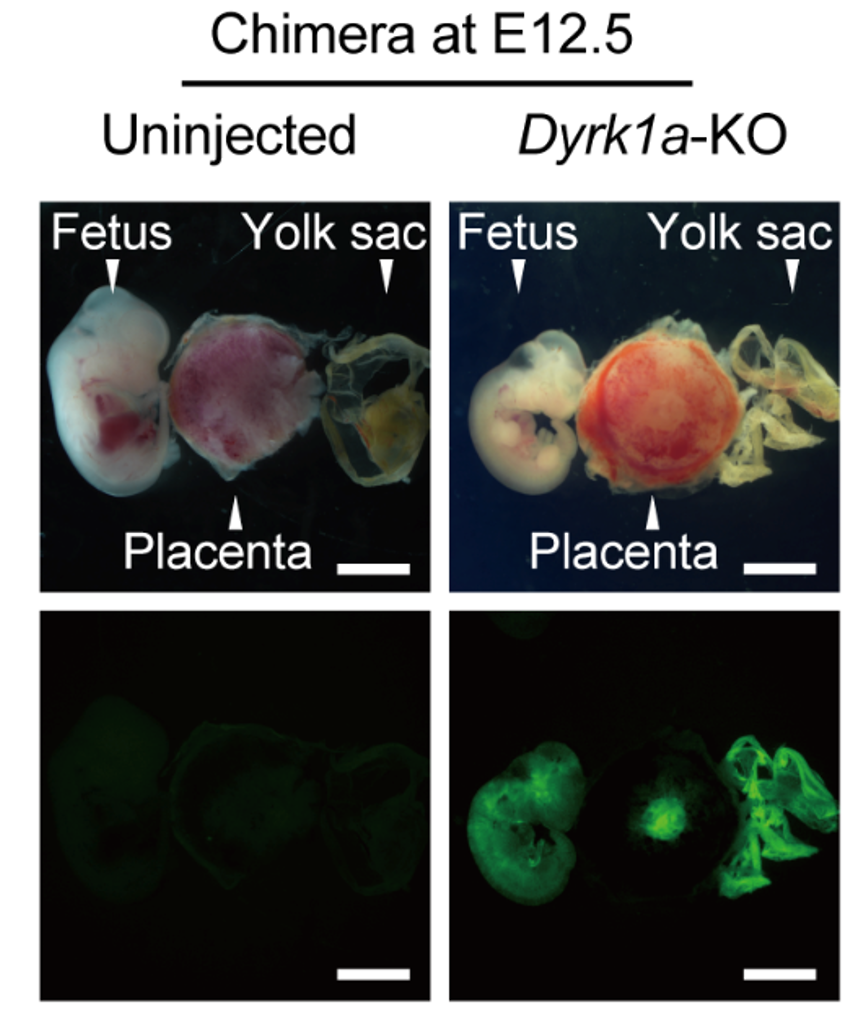
Dyrk1a敲除的ESCs通过囊胚注射可以嵌合发育贡献到胎儿、胎盘和卵黄囊相关组织
早期胚胎发育过程中,从受精卵发育到4-细胞到8-细胞时期,会出现第一次命运决定,相同的卵裂球会分化为两类完全不同的谱系,一部分形成内细胞团(进一步会发育为胎儿和卵黄囊),另一部分形成滋养层(进一步发育为胎盘)。对于小鼠而言,自然情况下内细胞团和滋养层谱系并不能够相互转变,其内在的限制机制尚不明确。内细胞团来源的胚胎干细胞(ESCs)和滋养层来源的滋养层干细胞(TSCs),因其在多种属性保留了来源细胞的特征,自然成为了在体外研究二者之间相互转变的理想工具细胞。
帅领课题组以小鼠单倍体ESCs为抓手,结合全基因组高通量突变,筛选能够调控ESCs往TSCs转变的关键基因。从大量的备选基因中挑选突变频次排名前两名的Dyrk1a和Catip进行敲除验证,均可高效的实现小鼠ESCs至TSCs的转变。
由于全能性的细胞只存在于早期发育的胚胎中,并不存在稳定的全能性细胞系,如何获得全能性的干细胞系一直是发育生物学和细胞生物学领域的研究热点。该研究将Dyrk1a-KO ESCs和近年报道的几株具备全能性功能的细胞系进行聚类分析,发现该细胞系在转录组水平上和北京大学杜鹏课题组的TBLCs(Shen et al, Cell, 2021)非常相似,而和清华大学丁胜课题组的ciTotiSCs (Hu et al, Nature, 2022)和中山大学王继厂课题组的TLSCs(Yang et al, Cell Stem Cell, 2022)相距较远。最后,帅领课题组对获得的Dyrk1a-KO ESCs进行嵌合体和类囊胚等功能验证,证明该细胞系不仅能够在体内发育中贡献到胎儿、胎盘和卵黄囊全谱系,还能够在体外高效形成与受精卵囊胚极其相似的自组装胚胎,表明Dyrk1a的敲除确实激活了一种类似于全能性的状态。
帅领表示,该研究不仅揭示大量调控小鼠ESCs往TSCs转变的关键基因,还为全能性的获得提供了新的思路,推动了发育生物学等领域的发展。
12月20日,介绍该成果的研究论文在线发表于国际学术期刊Science Advances上。南开大学药物化学生物学全国重点实验室帅领研究员、高倩博士和天津医科大学吴旭东教授为该论文的共同通讯作者。
论文链接:https://www.science.org/doi/10.1126/sciadv.adi5683
