得益于线虫的系统性RNAi特性,Andrew Fire和Craig Mello成功在线虫系统中揭示了双链RNA(dsRNA)引起RNAi的分子机制,从而获得2006年诺贝尔生理或医学奖。随后,哈佛大学Craig Hunter教授团队在系统性RNAi领域做出了开创性的贡献:2002-2003年,哈佛大学Craig Hunter教授团队在Science上连续发表论文,证明跨膜蛋白SID1是线虫系统性RNAi所必需的核酸转运通道(channel)。SID1是dsRNA通道的这种主流认识随即持续了二十多年,虽然也有研究认为SID1家族不转运核酸以及SID1家族是钠离子/核酸反转运蛋白。SID1在人源中具有两个同源蛋白SIDT1/2,研究发现SIDT1/2也具有核酸转运特性,因此,SIDT1/2作为开发基于RNA的疗法和药物的潜在靶点,受到越来越多的关注。SID1家族除了转运核酸的特性外,还在脂质代谢等生命过程中发挥重要作用,这使得SID1家族的功能机制变得更加复杂。2023年,龚德顺/闫创业/陈佺合作首次报道了SID1家族的第一个结构,揭示SIDT2以二聚体形式存在,并不是之前认为的dsRNA通道,并首次证明SID1家族还是一类膜内脂质水解酶,为理解SID1家族结构与功能的关系提供了全新的视角。遗憾的是,在低pH环境下,仍然没有看到加入的miRNA的密度。因此,SID1家族识别和转运dsRNA的分子机制仍不清楚。
2024年5月15日,龚德顺/闫创业/钱丹丹/丛野合作在Nucleic Acids Research上报道了线虫SID1蛋白单独存在以及与50bp-dsRNA复合物的结构,分辨率均高达2.2埃,成功揭示了SID1识别dsRNA以及区分RNA和DNA的分子机制,并为揭示SID1家族转运核酸的作用机制提供了重要线索。
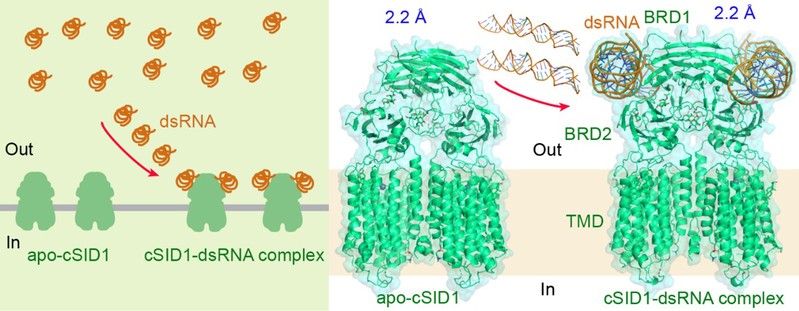
图1 SID1单独存在以及与dsRNA复合物的结构
通过结构分析发现,每一个SID1二体分子可以同时结合两个dsRNA分子,结合位点位于BRD1和BRD1的界面上,dsRNA几乎与膜平面平行(图1)。除了碱性残基与磷酸骨架之间广泛的离子相互作用外,dsRNA的2 ' -羟基与接触残基之间还形成了几个氢键,这解释了为什么SID1倾向结合dsRNA而不是dsDNA。此外,静电表面显示SID1上含有三个带正电的区域,且完美地贴合在dsRNA的三个大沟中。不同的是,人源SIDT1/2缺失这样的静电表面,这也解释了为什么人源SIDT1/2结合dsRNA的亲和力明显低于SID1,从而很难获得复合物的结构信息(图2)。
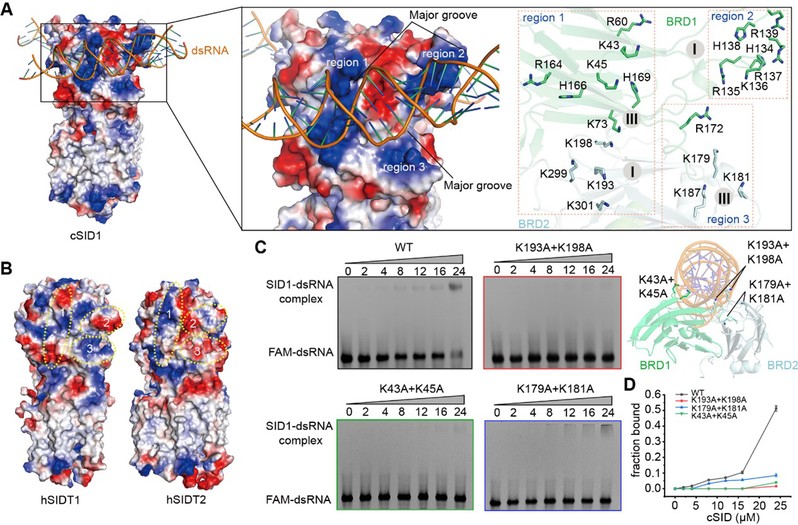
图2 SID1结合dsRNA的静电表面
基于结构,研究者们认为SID1也不是转运体(transporter),因为它几乎不可能通过alternating-access机制将不同长度的dsRNA转运通过细胞膜。有研究报道,SIDT2可以与接头蛋白复合物AP-1和AP-2相互作用,SIDT2还可以与载脂蛋白A1 (apoA1)结合,促进apoA1在肝细胞中的分泌。此外,SID1的家族的脂质水解酶活性也可能在调节膜脂质,促进膜的分裂与融合中发挥重要作用。这些结果表明SID1家族可能作为dsRNA的受体,通过“受体介导的内吞”机制转运dsRNA进入细胞。总的来说,该研究为进一步揭示SID1家族转运核酸的分子机制提供了基础和线索。
南开大学王润浩和清华大学丛野博士为论文共同第一作者,南开大学龚德顺研究员、清华大学闫创业教授、南开大学钱丹丹博士和清华大学丛野博士为论文共同通讯作者。该研究受到国家自然科学基金委的支持。
