蛋白质水解靶向嵌合体(PROTAC)技术是一种创新的癌症治疗策略。PROTACs是一种异双功能治疗药物,通过劫持体内泛素-蛋白酶体系统(UPS)从而降解目标蛋白(POI)。迄今为止,PROTAC已被用于降解多种致癌蛋白。尽管PROTAC技术取得了很大的进步,但PROTACs仍然存在膜通透性低和靶向传递差的问题。此外,高剂量的PROTAC药物倾向于形成二元复合物导致蛋白降解效力受限。因此,开发能够同时解决上述问题的新的PROTAC策略至关重要。

针对这一难题,南开大学化学学院、药物化学生物学全国重点实验室余志林课题组在《J. Am. Chem. Soc.》期刊上以“Sulfatase-Induced in Situ Formulation of Antineoplastic Supra-PROTACs”为题(DOI: 10.1021/jacs.4c00826),提出了一种基于细胞内硫酸酯酶响应多肽组装原位制备抗肿瘤超分子PROTACs的策略。该策略以肿瘤细胞过表达硫酸酯酶为刺激源,调控细胞内多肽原位组装。通过非共价共组装手段,引入分别与泛素连接酶和目标蛋白结合的配体分子,并根据两种配体的蛋白结合亲和力合理优化两种配体的比例,实现超分子PROTACs的原位构筑。该研究不仅为调控活细胞内多肽组装提供了一种新的方法,也为开发高效靶向传递和目标蛋白降解功能的PROTACs提供了新思路。
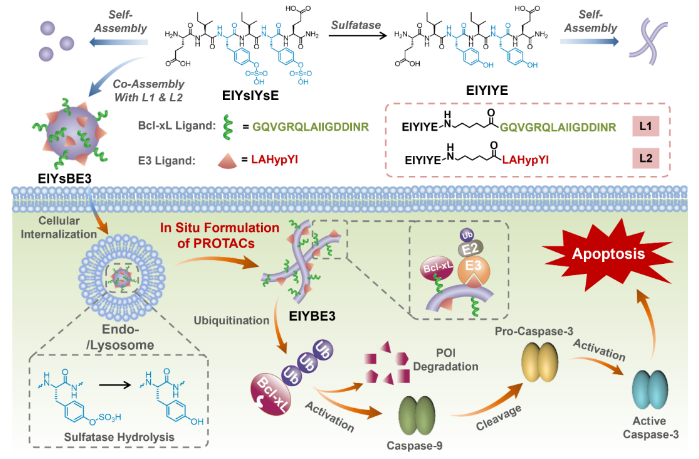
图1.基于细胞内硫酸酯酶诱导多肽原位组装的超分子PROTACs构筑及其肿瘤治疗机制示意图。图片来源J. Am. Chem. Soc.。
在前期构建刺激响应型多肽可控组装策略及生物医用功能材料的工作基础之上,余志林团队设计了一个核心序列中包含两个硫酸化酪氨酸残基的六肽(EIYsIYsE),同时合成了天然对应肽(EIYIYE),构筑了基于硫酸酯酶响应的多肽可控组装体系。此外,配体L1和L2分别能够与抗凋亡蛋白Bcl-xL和E3泛素连接酶VHL结合,在L1和L2对Bcl-xL和VHL的蛋白亲和力的指导下,将EIYsIYsE与L1和L2以适当的摩尔比共组装构筑超分子PROTAC EIYsBE3。在过表达硫酸酯酶的癌细胞中,超分子PROTAC EIYsBE3精确地经过酶响应组装成纳米纤维超分子PROTAC EIYBE3。EIYBE3特异性降解Bcl-xL蛋白,激活Caspase依赖的凋亡通路,从而达到肿瘤治疗的效果。因此,活细胞中多肽的原位自组装为选择性地在靶向位点上原位制备PROTACs提供了一种潜在的策略。溶液中的共组装实验表明酶催化的硫酸化共组件组装成明确的纳米原纤维,从而允许在硫酸酯酶催化水解后从前体制备超分子PROTAC,蛋白结合亲和力研究结果表明了肽纳米原纤维的形成在配体-蛋白相互作用和PROTAC功能中的关键作用。
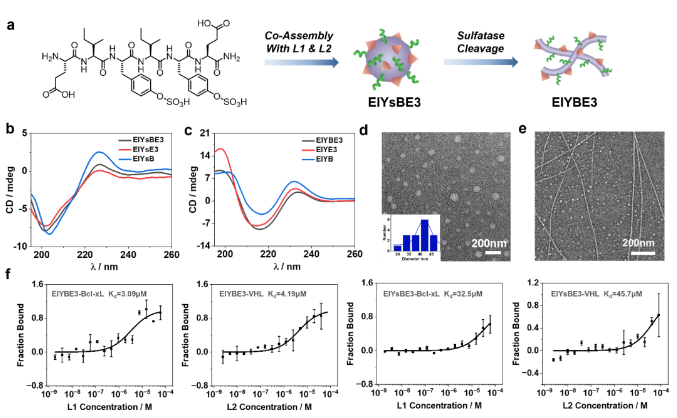
图2. 超分子PROTAC EIYsBE3的构筑及其结构于生物功能表征。
此外,通过活细胞水平的机制研究,超分子PROTAC EIYsBE3通过降解Bcl-xL和激活Caspase依赖的凋亡通路,选择性地对癌细胞产生明显的细胞毒性,同时合理优化的配体比例提高了目标蛋白的降解效力和细胞死亡的生物活性。体内研究表明,原位制剂增强了EIYsBE3的肿瘤积累和保留,以及在与化学药物联合给药时具有良好的生物安全性和抑制肿瘤生长的能力。该工作为活细胞中多肽的酶调控组装和开发具有高靶向传递和POI降解效率的PROTACs提供了一种新的方法。
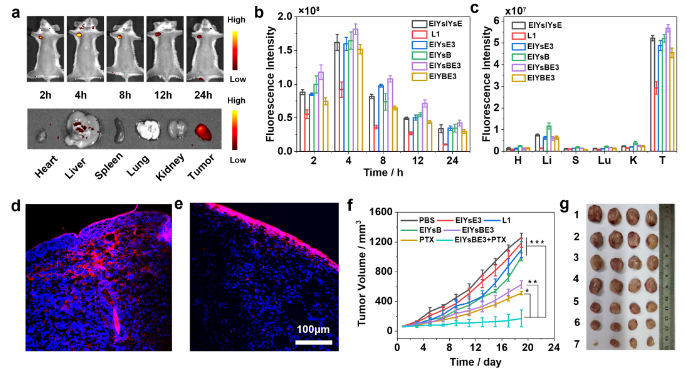
图3. 超分子PROTAC EIYsBE3的体内肿瘤治疗疗效。
这一成果近期发表在J. Am. Chem. Soc.上。文章的第一作者是南开大学与湖南师范大学联合培养2020级硕士研究生陈宁琳,南开大学博士研究生张泽宇为共同第一作者,南开大学化学学院余志林研究员、湖南师范大学张鹏博士及南开大学史洋副研究员为共同通讯作者。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.4c00826
