
对重大疾病的全面综合诊断和治疗是实现精准医疗的重要策略。恶性肿瘤目前仍然严重威胁着人类的生命健康。精准诊断可以提高肿瘤的早期检出率,但是单一成像模式往往无法提供全面的疾病信息。例如,荧光成像具有很高的灵敏度,但组织穿透能力有限;而光声(PA)成像则具有很好的穿透深度和空间分辨率,但灵敏度相对较低。因此,荧光和PA成像的结合可以更加精准地引导治疗。作为一种新兴的治疗模式,免疫治疗是一种非常具有前景的癌症治疗手段并且已经取得临床应用。然而,目前临床上很多病人对免疫治疗不敏感,主要是由于肿瘤的特殊微环境造成的。因此改善肿瘤免疫微环境可以大大提高免疫治疗的效果,如免疫原性细胞死亡(ICD)是一种激活肿瘤细胞免疫原性以增强抗肿瘤免疫反应的有效方法。由于肿瘤部位乏氧等条件的限制,单一的ICD试剂往往无法实现理想的效果。因此,联合免疫治疗成为治疗肿瘤的有效策略。
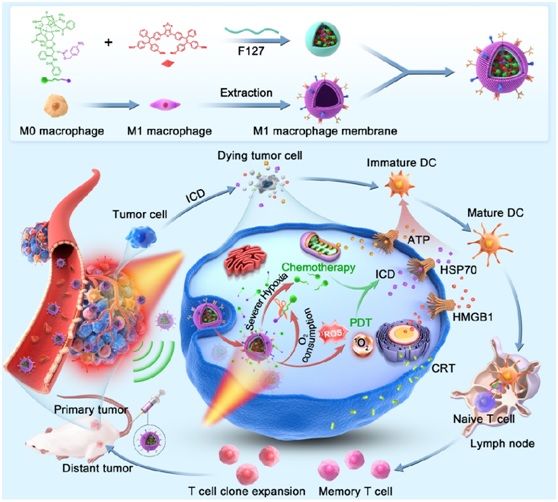
2023年8月25日,南开大学药物化学生物学全国重点实验室、生命科学学院的齐迹课题组,联合香港中文大学(深圳)唐本忠院士和中国医学科学院生物医学工程研究所李稳研究员,在Nature Communications杂志在线发表了题为A photo-triggered self-accelerated nanoplatform for multifunctional image-guided combination cancer immunotherapy的研究论文。该论文报道了一种具有自加速效果的有机诊疗试剂,可用于荧光和PA成像引导的精准治疗,通过高效的聚集诱导发光(AIE)光敏剂分子和乏氧响应前药的自增强ICD作用实现了1+1>2的联合免疫治疗效果。通过将高性能AIE光敏剂分子与乏氧反应性的紫杉醇(PTX)前药组装制备成纳米微粒,并进一步在表面修饰M1巨噬细胞膜提高肿瘤部位的靶向性,构建肿瘤靶向诊疗试剂。荧光和PA成像的结合可以在不同维度对肿瘤的位置和三维尺寸等进行可视化分析,为治疗提供精确的指导。成像的同时,该光敏分子兼备高效的I型和II型光动力治疗(PDT)性质,在光照诱导下产生活性氧并诱导ICD。光动力过程会消耗肿瘤中的氧气,使原来乏氧的肿瘤微环境进一步加剧,促进乏氧响应前药的高效释放,起到自加速的作用。这种光诱导的PDT和PTX前药联合的策略可以有效诱导ICD,不仅能够引发强烈的抗肿瘤免疫抑制乳腺癌,还能抑制远断肿瘤的生长,并且具有疫苗佐剂的效果。该工作通过合理的分子设计来开发治疗药物,为促进抗肿瘤免疫治疗提供了新思路和新策略。
南开大学为该论文的第一单位,本文共同第一作者是南开大学生命科学学院2021级博士研究生康晓颖和2022级博士研究生张源,共同通讯作者为齐迹教授、李稳教授和唐本忠院士。该工作得到了国家自然科学基金、天津市科技项目、南开大学药物化学生物学全国重点实验室等支持。
原文链接:https://www.nature.com/articles/s41467-023-40996-2
