
作为细胞内最丰富的二价阳离子,镁离子参与了一系列酶促反应,并且在细胞代谢途径中发挥着重要的作用。人源线粒体Mg2+通道Mrs2负责线粒体基质内Mg2+的稳态平衡,调控能量分子ATP的生产。但是Mrs2的三维结构和通透Mg2+的分子机制一直不清楚。
2023年8月5日,南开大学沈月全/杨雪团队在Nature Communications杂志上在线发表了题为Molecular basis of Mg2+ permeation through the human mitochondrial Mrs2 channel的文章。该研究运用冷冻电镜的方法解析了四种不同条件下人源全长Mrs2分子的结构,见下图。
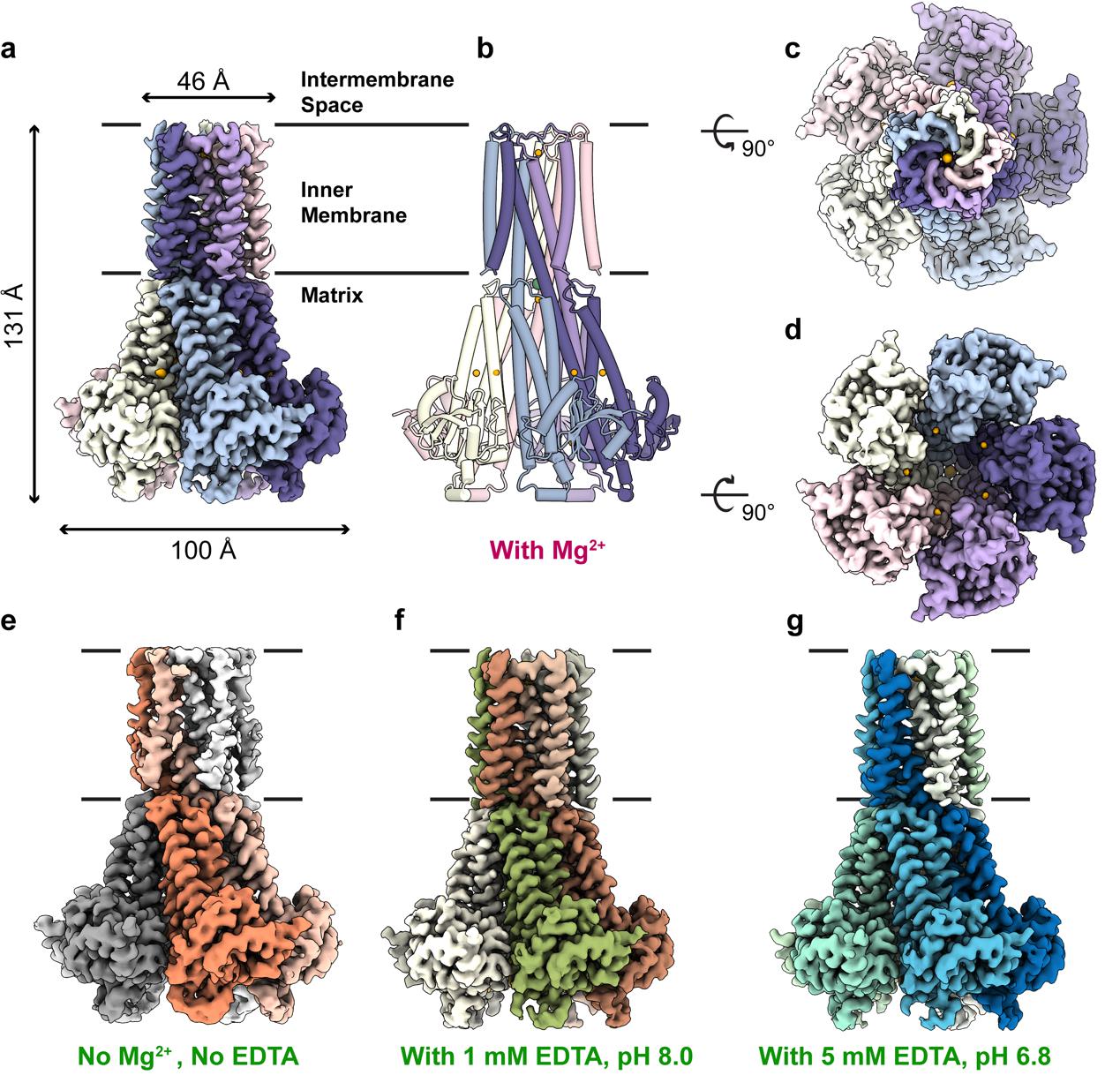
hMrs2通道不同状态下的结构示意图
结构显示hMrs2在不同状态下都呈现5重对称的排列模式。Mg2+孔道位于整个通道的中央。结构和功能研究发现hMrs2通道依赖于膜电势通透Mg2+。这个结论和以前文章提出的观点完全不一样。以前的观点认为线粒体基质Mg2+浓度变化诱导蛋白的构象变化,从而通透Mg2+。
我们发现hMrs2通道的门控是由一个特殊的结构单元实现的,即5个精氨酸(R332)形成一个环,中间结合一个Cl-。借助于分子模拟的方法,我们发现六水合Mg2+会吸引Cl-的结合,从而降低Mg2+水合数从6变成4,并帮助Mg2+跨过R332形成的正电荷屏障,在基质内负电荷氨基酸D329的帮助下,四水合Mg2+从Cl-上解离,进一步形成六水合Mg2+。
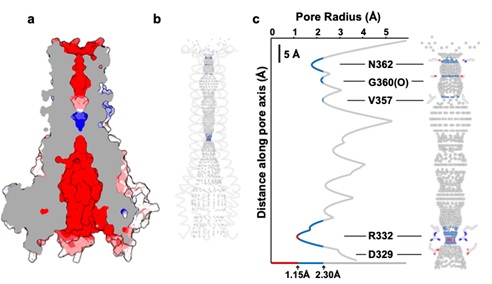
hMrs2通道的Mg2+通透孔道
这种由“负离子协助阳离子跨膜通透”的机理在细胞外膜钙离子通道Orai通透Ca2+的过程中也能被观察到。我们期望将来更广泛范围的离子通道研究可能会解锁更多类似的分子机制。
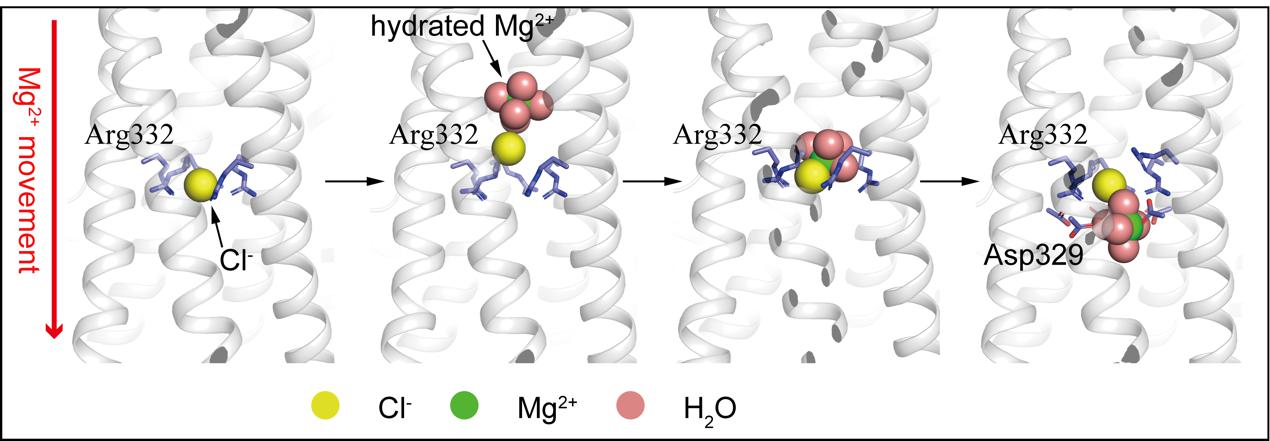
hMrs2通道通透Mg2+的分子模型
该工作是和浙江大学医学院张兴教授合作完成。南开大学药物化学生物学国家重点实验室的杨雪研究员和沈月全教授为本文的共同通讯作者,南开大学生命科学学院博士研究生李明和博士后李洋为本文的第一作者。该工作冷冻电镜数据采集于浙江大学冷冻电镜中心。
