酶作为天然催化剂,具有高效率、高区域选择性和高立体选择性等优异特性。然而,酶的稳定性较差,对操作环境高度敏感,且不具有加工性,限制了其实际使用。为解决上述关键挑战,利用多孔载体进行酶的固定化已成为一种行之有效的方法。框架材料特别是金属-有机框架(MOFs)作为一种新型固定化酶载体,具有结构丰富多变、高比表面积、孔径可调节和功能可定制化等优点,受到了广泛关注,然而,大多数结构的孔道尺寸不足以容纳酶分子,使得可利用的载体结构非常有限,另一方面,很多MOF结构的水稳定性不佳,而高稳定性的MOFs难以通过后修饰进行酶负载。南开大学陈瑶课题组长期聚焦高性能固定化生物催化剂创制,最早将酶固定在多孔框架材料(J. Am. Chem. Soc. 2011, 133, 10382; J. Am. Chem. Soc. 2012, 134, 13188),累计已经获得上千次的引用。首次将蛋白作为框架材料的结构模板剂,实现大量蛋白与载体原料的有序组装嵌合,形成高性能酶制剂(Angew. Chem. Int. Ed. 2020, 59, 6263);创建牺牲模板法构建大内腔高稳定性共价有机框架(COF)晶态胶囊,可实现5个维度的精确调节,制备了高效酶反应器(J. Am. Chem. Soc. 2020, 142, 6675);并进一步发展了温和条件下COF原位固定化酶的普适性方法,实现高性能的酶催化剂的规模化制备(Angew. Chem. Int. Ed. 2022, 61, e202208744)。上述载体的“硬件”创新迫切需要相应的“软件”升级,即创新晶态新型载体与酶分子的高效组装策略并探明相关内在机制,指导高性能固定化酶的创制,提升酶制剂的工业属性,使生物催化剂发挥最优效能。
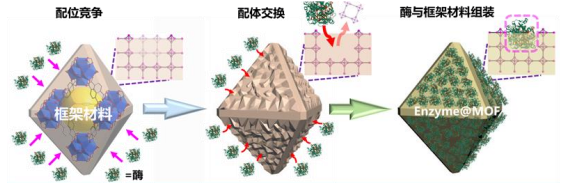
图1. 配位竞争固定化酶的普适性策略示意图
近日,南开大学陈瑶研究员团队报道了一种全新的动态缺陷生成机制,并利用该机制发展了生物大分子配位竞争的固定化酶的普适性新策略(图1),该策略将进一步突破载体构筑和应用的壁垒,使得稳定的“微孔”框架材料得以突破孔道尺寸限制,高效负载远大于其孔道尺寸的酶分子,应用于固定化酶和生物催化。所制备高性能Enzyme@MOFs催化剂不仅具有高催化活性,还具有优异的稳定性和重复利用性。在该新型酶固定化策略中,生物大分子(酶)可以作为“巨型配体”,与MOF配体进行配位竞争从而产生结构缺陷。该团队利用结构光照明显微镜(SIM)直接清晰观测到整个动态过程:随着酶分子与载体作用时间延长,生物大分子从材料表面逐渐进入内部(图2)。这种策略的显著优势在于:只需简单的将MOF材料在常温下浸泡在酶的溶液中,即可获得固定化酶制剂,非常便于工艺放大(克级生产)。即使MOF孔道尺寸远小于生物大分子,不同类型的生物大分子(如脂肪酶、葡萄糖氧化酶、甲酸脱氢酶、过氧化氢酶、抗体)仍可以被高效地固定在MOF中,而不发生泄露。所制备的生物催化剂表现出优异稳定性、回用性以及生物催化活性(手性拆分活性和酯水解活性)。经过多次循环,可保持80%以上活性(图3)。此外,配位竞争固定化的新策略可与其他固定化策略进行联用(如机械球磨固定化),获得内外区隔化多酶级联反应器(图4)。这项研究突破了材料孔道的尺寸限制,为种类繁多、数量丰富的微孔、高稳定框架类材料应用于固定化生物大分子重要领域开辟了道路。该方法具有优异的普适性,在酶制剂、生物制剂等领域展现出广阔的应用前景,并可融合多种固定化策略制备高效生物催化剂,更为重要的是,该研究为晶态固定化酶制剂的绿色规模化制备开创了全新思路。
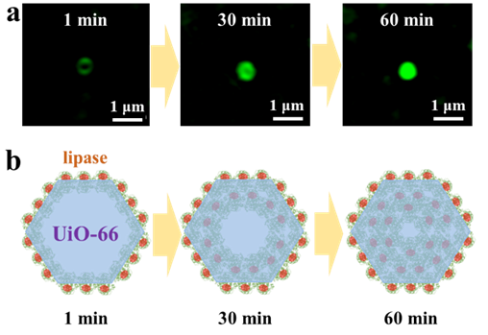
图2. 通过SIM研究lipase@UiO-66的固定化机理
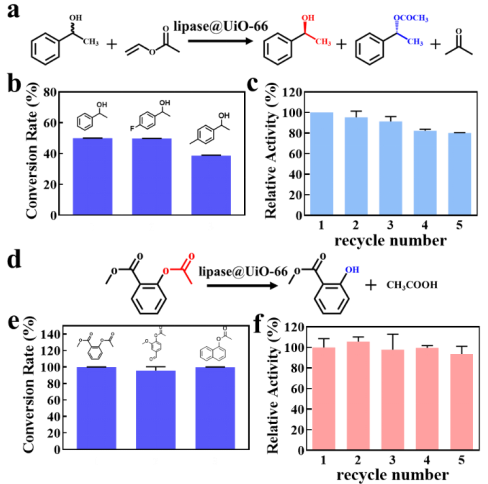
图3. lipase@UiO-66的手性拆分和酯水解性能
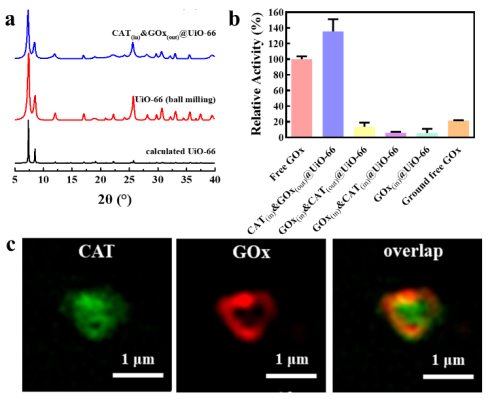
图4. 内外区隔化的enzyme@UiO-66多酶级联反应器
这一成果以“A Dynamic Defect Generation Strategy for Efficient Enzyme Immobilization in Robust Metal-Organic Framework for Catalytic Hydrolysis and Chiral Resolution”为题目近期发表在Angew. Chem. Int. Ed.(2023, DOI: 10.1002/anie.202302436)上,通讯作者是南开大学药物化学生物学国家重点实验室陈瑶研究员,共同第一作者是南开大学药学院博士研究生冯一帆、硕士研究生施瑞璇、博士后杨铭方。该工作得到国家重点研发计划、国家自然科学基金等项目的支持。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202302436
