沈月全/杨雪团队解析感知机械力疼痛离子通道TACAN的单颗粒冷冻电镜结构
2022年3月1日,南开大学沈月全/杨雪课题组在研究论文“Cryo-EM structure of the human TACAN channel in a closed state”发表在Cell Reports上,该研究运用单颗粒冷冻电镜技术解析了TACAN蛋白静息状态的三维结构,并结合电生理实验和分子动力学模拟的方法,确定TACAN的离子通过路径以及可能的机械门控机制。

图1. TACAN蛋白可能的激活机制模型
组织在外力作用下产生机械性变形,当变形的程度超过机械感受器的感应阈值时,伤害感受器被激活, 并通过机械力敏感通道开放来实现信号传导,从而产生机械性疼痛。2020年3月,加拿大科学家发现了一个新型离子通道,命名为TACAN,可以感知日常生活中的急性机械性疼痛。2021年5月,美国科学家进一步利用大鼠模型发现TACAN在炎症产生的机械性痛觉中发挥作用,但是在化疗诱导的机械性痛觉中不起作用。然而,2021年8月在Elife同一期杂志上,美国洛克菲勒大学2003年诺贝尔奖得主Roderick Mackinnon课题组,美国德克萨斯西南研究中心Youxing Jiang课题组,中科院生物物理所刘振峰课题组/赵岩课题组/清华大学肖百龙课题组背靠背发表了三篇文章,他们解析了TACAN的冷冻电镜结构,并一致认为TACAN可能是一个辅酶A结合蛋白而非机械敏感性离子通道。2021年8月,西湖大学闫浈课题组,在Cell Discovery杂志上发表文章报道了TACAN及其同源蛋白TMEM120B的冷冻电镜结构,认为TACAN生物学功能可能是脂代谢过程中的酶。这一系列基于TACAN三维结构的文章挑战TACAN作为离子通道的生物学功能,但是遗憾的是,也未能提供强有力证据来确定TACAN的真实生物学功能。
沈月全/杨雪课题组分析TACAN的冷冻电镜结构发现TACAN二体的组装和另外一个机械力敏感通道OSCA(植物渗透压敏感机械力通道)二体存在着很大的相似性。对TACAN进行分子动力学模拟发现:在静息状态下,水分子不能在蛋白内外两侧形成连续的通路,表明此时的TACAN处于关闭状态;在分子动力学模拟系统中施加磷脂双分子层的拉力达到35 mN/m时,水分子可以从TACAN单体的中间孔道通过,并在磷脂双分子层内外两侧形成连续的通路。其中,M207,F223以及N165三个氨基酸残基组成孔道的限制性区域。利用电生理技术测量电流发现,在响应膜张力的时候,野生型TACAN的电流变化幅度并不明显;然而,门控氨基酸M207A突变体的在响应膜张力以后,电流增加了近六倍。因此,该团队认为TACAN蛋白在静息状态下,处于一种关闭状态(这一点和其它课题组发表的结果类似),可能需要其他未知的辅助因子来帮助通道转变成另外一种状态(比如预激活状态),在感知机械力后,才能进一步转换成开放状态。这种双重锁定的机制和TACAN作为急性机械疼痛的生物学功能是相符的。
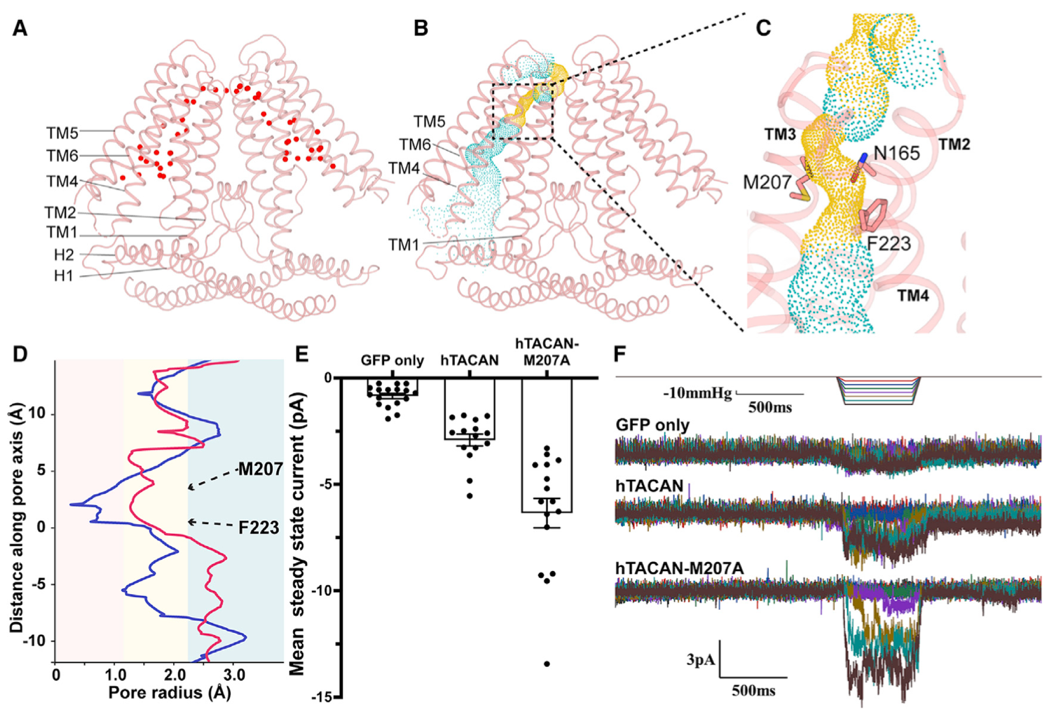
图2. TACAN的离子传导路径
南开大学药物化学生物学国家重点实验室的沈月全教授和杨雪副研究员为本文的共同通讯作者,南开大学生命科学学院博士研究生陈晓哲、王耀杰、博士后李洋为本文的共同第一作者。该工作冷冻电镜数据采集于浙江大学冷冻电镜中心。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(22)00172-3
