原纤毛(primary cilia)是一种以微管为基础的细胞器,几乎存在于人体所有细胞表面。这种毛发状结构在机械力感知,Hedgehog-、Wnt-、血小板衍生生长因子受体α-信号通路的信号传导,以及左右不对称性的确定等生理进程中发挥着重要作用。原纤毛结构与功能的异常导致超过35种被称为纤毛病的人类遗传性疾病的发生。
Meckel-Gruber综合症(MKS)由Johann Friedrich Meckel在1822年首次报道。随后G. B. Gruber于1934年报道了相同疾病并将其命名为dysencephalia splanchnocystica。MKS是一种罕见的常染色体隐性遗传病,患者以多囊肾、枕脑膨出、轴后性多指为典型特征。同时还伴随其他疾病,包括唇腭裂、生殖器异常、中枢神经系统畸形、和肝纤维化等。MKS是纤毛病中最致命的一种,患MKS的胎儿在子宫内或出生后不久便死亡,死亡率为100%。全球范围内,该病在新生儿中的发病率为1/140000~1/13250。
目前,已发现14种基因的突变与MKS相关。其中,Meckelin基因的突变是导致MKS的主要原因。Meckelin基因编码一个含有995个氨基酸的跨膜蛋白Meckelin,又名TMEM67和MKS3。它的突变也是Joubert和COACH综合症的主要原因。研究发现,Meckelin是中心体向顶膜迁移以及随后形成原纤毛所必需。因Meckelin含有一个Cystine-rich domain (CRD)和7次跨膜螺旋结构,被认为是与Frizzled类GPCR相似的受体,可以识别Wnt信号。虽然在理解Meckelin功能方面取得了一些进展,但其具体生理功能仍不明确。因目前仍缺乏Meckelin的任何结构信息,极大地阻碍了对其作用机制的理解和靶向药物的研究。
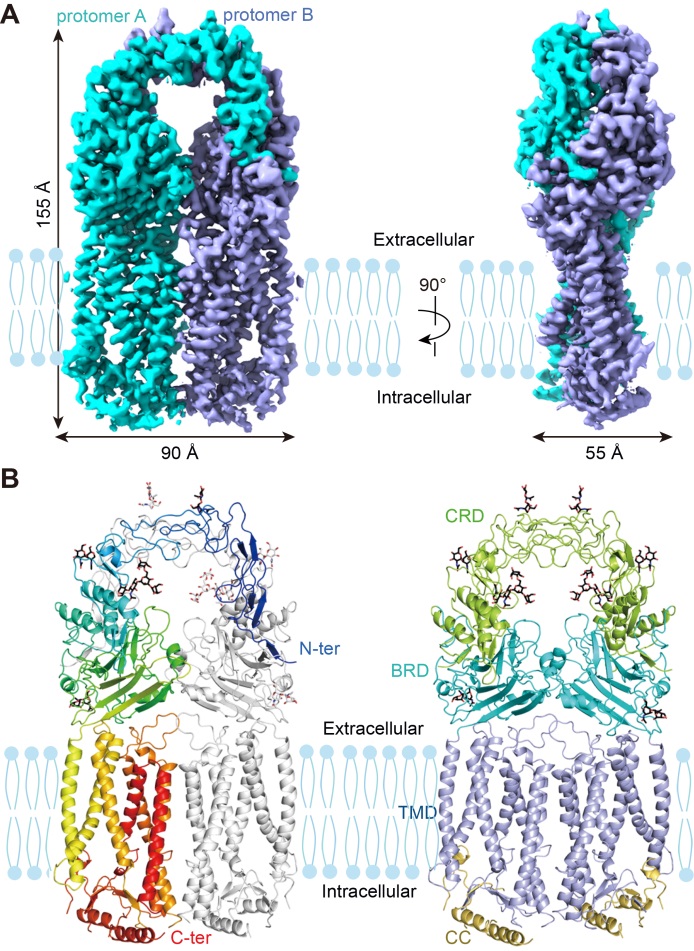
2021年11月3日,南开大学药物化学生物学国家重点实验室/生命科学学院龚德顺研究员团队在Science Advances杂志发表题为Structure of the human Meckel-Gruber protein Meckelin的研究论文,该研究利用冷冻电镜技术,首次解析了人源Meckelin的3.3埃分辨率的冷冻电镜结构,揭示了Meckelin的独特折叠模式和众多疾病相关突变体的潜在致病机理,为未来揭示Meckelin的功能机制和致病机理以及相关纤毛病的药物研发奠定了重要结构基础。
一直以来,Meckelin被认为其结构与Frizzled类GPCR结构相似。通过结构解析发现,Meckelin与Frizzled类GPCR的结构完全不同,呈现一种全新的蛋白折叠模式。其包含4个结构域:位于胞外的CRD和BRD(beta-sheet rich domain),穿膜结构域(TMD),和位于胞内的卷曲-卷曲(CC)结构域组成。CRD以反平行的方式形成一个类似于拱桥的二聚体,由22对二硫键维持其稳定和刚性。BRD作为桥梁连接CRD和TMD。TMD呈现一种全新
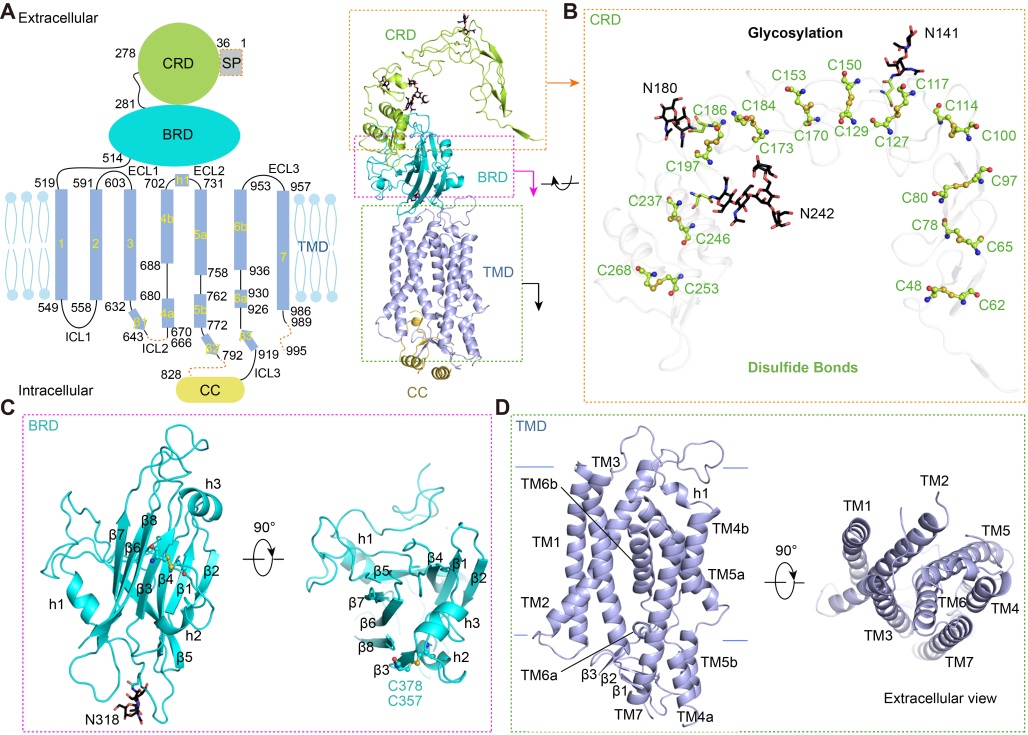
图2 Meckelin单体的结构
的折叠模式,其TM4-TM6在靠近细胞质一侧均解旋,从而形成了两个带正电的口袋。每个口袋均包含一个穿膜区开口(TM opening)和一个细胞质开口(intra-cellular opening)。Meckelin单体与单体之间通过四个区域的广泛结合形成了稳定的二聚体。
进一步将疾病相关突变体定位到结构上,发现CRD/BRD和BRD/TMD结构域界面为两个突变热区,暗示BRD在介导从CRD到TMD的信号传导中发挥重要生理功能。有趣地是,在24个与MKS相关的突变体中,有10个位于CRD/BRD界面,表明此界面对于MKS发病尤为关键。在穿膜区的其中一个带正电口袋中,包含5个均可引起电荷改变的疾病相关突变体,说明此口袋具有重要生理功能。此外,在二聚体结合界面发现众多疾病相关突变体,可能导致二聚体的不稳定,表明二聚体可能是Meckelin发挥功能所必需。
最后,作者发现全长的Meckelin确实可以结合Wnt5a配体,然而其识别机制仍需进一步解析。总的来说,该研究为未来对Meckelin进行生化、生物物理、细胞、以及计算分析奠定了基础,有助于进一步揭示Meckelin的功能机制和致病机理。
西湖大学生命科学学院博士后刘栋梁博士为论文第一作者,南开大学药物化学生物学国家重点实验室/生命科学学院博士后钱丹丹博士为论文共同第一作者,西湖大学生命科学学院申怀宗研究员提供了巨大帮助,南开大学药物化学生物学国家重点实验室/生命科学学院龚德顺研究员为论文的通讯作者。
