钙离子(Ca2+)作为一种多功能信使,精确调控着细胞和生命体活动的每个环节,细胞外Ca2+稳态的维持和调控对于生命体的代谢功能至关重要。钙敏感受体(CaSR)属于C家族的G蛋白偶联受体(GPCR),定位于细胞质膜,可以感知细胞外Ca2+浓度的细微变化并将信号传递到细胞内。CaSR的突变、异常表达和受体活性改变将导致多种疾病,例如I型家族性低尿钙性高血钙症(FHH1),新生儿严重甲状旁腺功能亢进症(NSHPT),I型常染色体显性遗传性低钙血症(ADH1)和哮喘等。
2021年6月4日,南开大学杨雪/沈月全团队在Science Advances杂志上发表了题为Structural basis for activation and allosteric modulation of full-length calcium-sensing receptor的文章,该研究运用冷冻电镜的方法解析了四种不同条件下(激活态、负变构调节态、正变构调节态以及失活态)的全长CaSR的结构。结合生物化学实验,他们发现,失活态的CaSR处于开放状态,Ca2+和色氨酸可以与CaSR的捕蝇草结构域(VFT)结合,从而引起VFT结构域关闭并进一步诱导CaSR的半胱氨酸富集区(CR)和七次跨膜螺旋结构域(7TMD)彼此靠近,从而激活全长的CaSR分子。负变构调节剂药物可以结合激活态CaSR的7TMD,诱导二体重排并形成一种新的7TMD间的作用界面。正变构调节剂药物结合激活态CaSR的7TMD后,CaSR会继续保持相似的7TMD二体结构域界面。

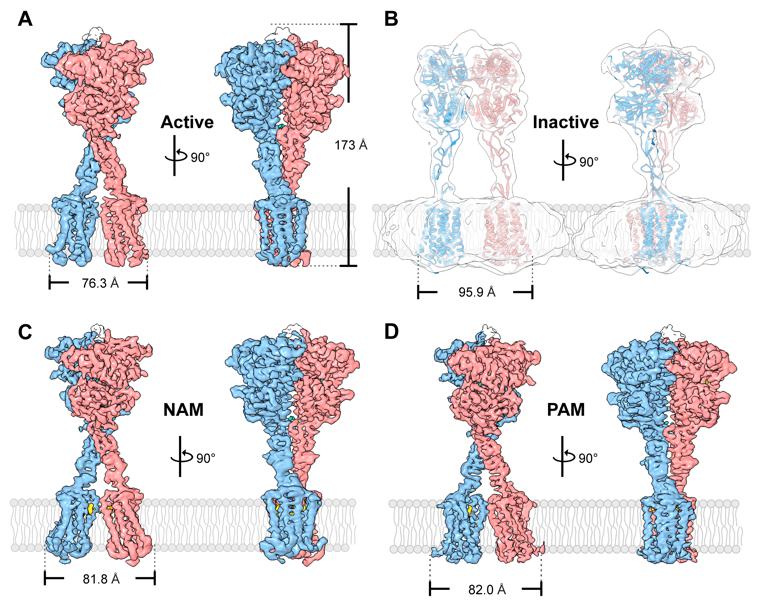
全长钙敏感受体的四种构象态
在全长ggCaSR-active的高分辨率结构基础上,他们将属于五种临床疾病的305个错义突变定位到结构中,创建了疾病突变位点的热点图。相关疾病的药物开发和治疗提供指导。

钙敏感受体错义突变导致的疾病热点分布图
该工作和浙江大学医学院张兴教授合作完成。南开大学药物化学生物学国家重点实验室的杨雪副研究员和沈月全教授为本文的共同通讯作者,南开大学生命科学学院博士研究生温天蕾为本文的第一作者。该工作冷冻电镜数据采集于浙江大学冷冻电镜中心。
